日本医薬品添加剤協会 |
日本医薬品添加剤協会 |
|
和名 ヒドロキノン (関連誘導体を含む) 英文名 Hydroquinone CAS 123-31-9 (link to ChemIDplus) 別名 ハイドロキノロン、p-ジヒドロキシベンゼン、1,4-ジヒドロキシベンゼン、ヒドロキノール、キノール 収載公定書 薬添規(JPE2018), 外原規(2006) USP/NF(27/22) 用途 安定(化)剤 以下の内容には、関連誘導体のデータを含む。 ■単回投与毒性 (link to ChemIDplus) 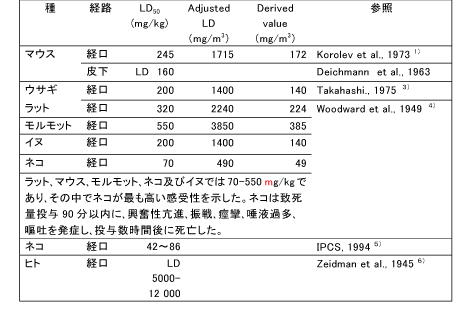 Revised IDLH(Immediately Dangerous to Life or Health Concentration): 50 mg/m3。経口用量5-12gは6)(Zeidman et al., 1945)、労働者が呼吸速度50リットル/分、100%吸収で3333-8000mg/m3濃度に30分間暴露されたものと等しい。IDLH値の基礎となる吸入毒性データがないため、ヒト6)(Zeidman et al., 1945)及び動物4)(Woodward et al., 1949)における急性経口毒性データを基に、Revised IDLHを50mg/m3とした。 7)(CDC, 1996) 数種の動物種に対する経口によるLD50値は、300~1300mg/kgの範囲である。しかし、ネコのLD50値は42~86mg/kgである。急性の高濃度暴露は中枢神経系(CNS)に対して作用し、過剰興奮性、振戦、痙攣、昏睡など重篤な影響を及ぼし死亡させる。致死量以下の用量(sublethal doses)による影響は可逆的である。経皮吸収によるLD50値は、齧歯類において3800mg/kg以上と推定されている。吸入によるLD50値は入手できない。5) (IPCS, 1994) 既存化学物質安全性(ハザード)評価シート8)(経済産業省, 2000) 致死量を経口投与した実験では、マウス、ラット、ウサギ、モルモットでは30-90 分以内に過剰興奮、振戦、痙攣、呼吸困難、チアノーゼがみられ、イヌでは前記症状に加えて流涎、嘔吐、眼周囲の腫脹、後肢運動失調、ネコでは流涎、眼周囲の腫脹がみられ、これらの症状に引き続いて衰弱、低体温、麻痺、反射消失、昏睡、呼吸不全が起こり死亡する。致死量以下では3 日以内に回復している。5)(IPCS, 1994) マウスに500 mg/kg を皮下投与した実験では、運動の活発化、反射亢進、光及び音への過敏反応などの中枢神経系の症状や、呼吸困難、チアノーゼに続いて間代性痙攣、運動疲弊、麻痺、感覚及び反射の消失、半昏睡がみられ死亡している。5)(IPCS, 1994) ラットに200、400 mg/kg を強制経口投与した実験では、投与24 時間以内に顕著な尿中アルカリ性フォスファターゼの増加及び糖尿がみられている。5)(IPCS, 1994) 9)(Rodney JB. et al., 1996)。 ■反復投与毒性 (link to TOXLINE) マウス 14日間経口投与試験: 1群雌雄各5匹の6-8週齢のB6C3F1マウスに、コーン油に溶解したHQ(純度99%以上) 0, 31, 63, 125, 250及び500 mg/kg を5日/週、14日間強制経口投与した。振戦を発症した後、回復するか、あるいは痙攣となり死亡した。死亡率は雄では250 と500mg/kg投与群でのそれぞれ3/5と4/5であり、雌では500mg/kg投与群で5/5であった。10)、11) (Kari et al., 1989&1992) 13週間経口投与試験: 1群雌雄各10匹の8-9週齢のB6C3F1マウスに、コーン油に溶解したHQ(純度99%以上) 0, 25, 50, 100, 200及び400 mg/kgを5日/週、13週間強制経口投与した。1日2回観察を行い、1週間に1回、体重を測定した。死亡動物は試験開始後早期に発生した。振戦が雄では400 mg/kg群の全例、雌では200と400 mg/kg群に、検体投与後に発症した。振戦の後、しばしば痙攣が現れた。死亡率は雄では200と400 mg/kg投与群で2/10と8/10であり、雌では400mg/kg投与群で8/10であった。試験終了時の平均体重において、対照群と投与群の間に差は認められなかった。相対肝重量は雄ではコントロールに比較して何れの用量でも増加した。前胃には潰瘍、炎症、及び上皮過形成が400 mg/kg投与群で雄の3/10と雌の2/10に、200 mg/kg投与群で雌の1/10に発症した。以上の成績から、2年間試験の用量は100と50mg/kgを選択した。10)、11) (Kari et al., 1989&1992) 14日間経皮投与試験: 1群雌雄各5匹の6-8週齢のB6C3F1マウスに、95%エタノールに溶解したHQ(純度99%以上) 0, 300, 600, 1200, 2400及び4800mg/kgを14日間、毛を剃った肩甲骨間に皮膚塗布した。全てのマウスが試験終了時まで生存した。全マウスの試験終了時の平均体重は、試験開始時と比較して低値であった。4800 mg/kg投与群の皮膚及び柔皮にHQの結晶が見られた。10) (Kari et al., 1989) ラット 14日間投与試験: 1群雌雄F344/Nラットに、コーン油に溶解したHQ(純度99%以上) 0, 63, 125, 250, 500及び1000 mg/kgを14日間強制経口投与した。死亡は雄では500と1000mg/kg投与群で投与開始10日と1-4日に出現し、その死亡率は1/5と5/5であった。振戦は投与30分後から現れた。雌でも同様な傾向で死亡し、その死亡率は500と1000mg/kg投与群で4/5と5/5であった。10)、11) (Kari et al., 1989&1992) 13週間経口投与試験: 1群雌雄各10匹の7-8週齢のF344/Nラットに、コーン油に溶解したHQ(純度99%以上) 0, 25, 50, 100, 200及び400 mg/kg を5日/週、13週間強制経口投与した。1日2回観察を行い、1週間に1回、体重を測定した。死亡例は雄では400 mg/kg投与群の10/10が試験2-13週に発生し、雌では200と400 mg/kg投与群で3/10と10/10が試験1-11週に発生した。主な死亡時期は試験7週以内であった。一般状態として、死亡動物では振戦から痙攣となり死に至った。生存動物では200 mg/kg投与群において雄は試験10週後から不活発となり、雌は振戦と時折痙攣が現れた。最終平均体重は対照群に比して、雌ではすべての投与群で変化がなかった。相対肝重量が雄の25?100 mg/kg群で有意に減少し、雌では50mg/kg以上投与群で有意に増加した。前胃の上皮過形成が200mg/kg投与群の雄の4/10と雌の1/10発症し、腎皮質の尿細管細胞変化に特徴づけられる腎症が200 mg/kg投与群で雄の7/10と雌の6/10に、100mg/kg投与群で雌の1/10に発症した。以上の成績から、2年間試験の用量は25と50mg/kgを選択した。10)、11) (Kari et al., 1989,1992) 4週間経口投与試験: 1群5匹Wistarラットに、2%HQ添加飼料を4週間給餌したところ、上部食道の開口領域に中等度の肥厚及び過角化症が少数例に発生した。 12)(Altmann et al., 1985) 神経毒性試験: ラットにおける機能-観察組み合わせ手法を用いた90日試験においては、HQ 64および200mg/kgでは振戦(ふるえ)を、HQ 200mg/kgの場合には一般活動性の低下を生じさせた。神経病理学的検査の結果は陰性であった。5) (IPCS, 1994) 腎毒性作用: 単回経口投与試験: F344ラット雄(160-200 g)に用いた。HQは1.8 及び4.5 mmol/kgで経口投与し、あるいはHQ代謝物のひとつである2、3、5-(tris- glutathion-S-yl)hydroquinone (2,3,5-TGSH)は7.5micromol/kg(1.2-1.5micromol/rat)で 静脈内投与した。腎毒性の指標として、血液ではblood urea nitrogen (BUN)を、 尿ではgamma-glutamyl transpeptidase (gamma-GT)、 alkaline phosphatase (ALP)、 glutathione-S-transferase (GST) 及び糖を測定した。 HQは身震いを発症させた。HQ 1.8 mmol/kg経口投与群では腎毒性が数匹に認められたが、他の投与群には認められなかった。けれども腎の近位尿細管、分節3での上皮細胞にBrDU 標識細胞が腎毒性の程度応じて現れた。 HQ 4.5 mmol/kg経口投与群 では尿中にgamma-GT、 ALP 及びGSTが有意に上昇した。アシビシン前処置すると、HQ腎毒性の発現は防止できた。このことはHQ腎毒性がgamma-GT を必要とするHQ代謝物に依存することを示している。この見解と一致して、HQ代謝物のひとつである2、3、5-TGSHはBUNや尿中urinary gamma-GT 及びALPの濃度を上昇させ、それらのピーク時間は投与後12時間であった。それに反して、GSTと糖の尿中濃度のピーク時間は投与後24時間であった。BUNと糖の値は投与後72時間までに正常値にもどったが、gamma-GT、 ALP及びGSTのレベルは軽度に上昇したままだった。光学顕微鏡によるスライス標本の病理所見では,腎の近位尿細管上皮細胞壊死が近位尿細管、分節3から髄放線まで観察された。この領域には細胞増殖率(BrDU 標識細胞発生率)が対照群で0.8-2.4%に比して、投与後12, 24, 48及び72時間でそれぞれ 2.4, 6.9, 15.3及び 14.3%であった。代謝試験成績も、HQの毒性及び発癌性におけるhydroquinone-thioether代謝物の作用を示している。13) (Peters et al., 1997) 腎毒性作用: 6週間経口投与試験: 雌雄F344ラットに、HQ 2.5, 25及び50 mg/kg を5日/週、6週間にわたって1日1回強制経口投与した。腎臓から分離された核DNAをphosphorus-32 postlabeling法で検査した。50 mg/kg投与群の雄で、近位尿細管障害の指標となるN-アセチル-ベータ-D-グルコサミダーゼの排泄率上昇が認められたが、雌では認められなかった。組織標本でのPostlabeling法の核DNA付加体検査により、HQが雌雄ラットの腎臓でDNA付加体を産出しなかったことが明らかになった。DNA付加体の検出限界は10-9ないし10-10であった。HQ及びp-ベンゾキノンの主な試験管内付加物に一致するような場所示すクロマトグラムのバックグラウンドの放射能レベルで、HQ投与に関連する上昇はみられなかった。HQ投与は、ある内因性付加物(I-compounds)濃度を減少させたが,I-compoundsの生物学的性質は不明である。14) (English et al., 1994) 腎毒性作用: 6週間経口投与試験: F344ラット雌雄に、HQ 0、2.5、25及び50 mg/kgを1, 3, 6週間強制経口投与した。また、SDラット雄にHQ 0, 2.5, 25及び50 mg/kgを6週間強制経口投与した。近位尿細管の分節1、2、3(P1, P2, P3)及び遠位尿細管の直部と曲部の各部位における細胞増殖を計量化し、腎毒性早期発症に関する特徴を調べた。細胞増殖は、免疫組織化学染色法にてブロモデオキシウリジン(BrdU)取り込みを定量化した新たなDNA合成により評価した。6週後に腎細胞増殖の増加がF344ラット雄50 mg/kg投与群に認められた。P1及びP2 では87%及び50%と有意に上昇したが(P<0.001)、P3では34%と有意に上昇しなかった。尿検査では、近位細管障害の指標となる酵素排出率が上昇した。腎臓の組織病理学的検査では、尿細管変性がF344雄ラットで用量に相関してみられた。そのような変性はF344雌ラット及びSD雄ラットの腎臓では観察されなかった。これらのデータは、2年間の発がん性試験における性及び種に特化した腎臓腺腫の所見と一致し、化学物質の毒性に続発する細胞増殖がHQ投与のF344雄ラットに発生する良性腎腫瘍の病因として重要であることを示唆している。15) (English et al., 1994) イヌ 雑種犬で2つの同腹子からなる月齢4ヶ月の子犬、雌3匹と雄2匹を、イヌ小屋「Pard」(Swift製品)に収容し、「Esbilac」(Borden製品)で食事を補った。その内2匹を対照群とし、その他の3匹のうち1匹にHQ 16mg/kg/日を80週間投与した。残りの2匹にはHQ 1.6mg/kg/日を31週間に亘り投与し、続いて40mg/kg/日を49週間投与した。また、雄の成犬5匹には、HQ100mg/kg/日を26週間投与した。HQの糖衣錠を餌に混ぜて投与した。定期的な血液、尿検査も行った。実験終了後、犬を解剖した。HQ 1.6, 16及び40 mg/kg/日を80週間に亘って投与した子犬は正常に成長し、HQ 100 mg/kg/dayを26週間に亘って投与した成犬の体重に変化は見られなかった。投与群の肉眼的剖検、尿検査、血液学的分析は正常であり、病理学的変化も観察されなかった。しかし、対照群の脾臓、肝臓、骨髄でより顕著なヘモジデリン沈着症が見られた。16) (Carlson et al., 1953) 既存化学物質安全性(ハザード)評価シート8)(経済産業省, 2000) 経口投与 マウス マウスに31、63、125、250、500 mg/kg/day を5 日間/週×2 週間強制経口投与した実験で、250 mg/kg/day 以上で振戦、痙攣、死亡がみられている。5)(IPCS, 1994) マウスに25、50、100、200、400 mg/kg/day を13 週間強制経口投与した実験で、25 mg/kg/day以上で嗜眠、肝臓相対重量の増加、200 mg/kg/day 以上で振戦、前胃の潰瘍、炎症、上皮の過形成、400 mg/kg/day で痙攣がみられている。5) (IPCS, 1994) 死亡例は200 mg/kg/day 以上でみられている。5) (IPCS, 1994) マウスに50、100 mg/kg/day を15 ヵ月間強制経口投与した実験で、100 mg/kg/day で肝臓の相対重量の増加、腎臓重量の増加がみられ、肝臓では小葉中心性脂肪変性、巨細胞、多核細胞がみられている。5) (IPCS, 1994) マウスに0.8%の濃度で96 週間混餌投与した実験では、肝細胞肥大と前胃粘膜の過形成がみられている。5) (IPCS, 1994), 17) (IARC, 1999) マウスに50、100 mg/kg/day を5 日/週×103 週間強制経口投与した実験では、肝臓での核の大小不同症、多核細胞の増加が用量に相関してみられている。17) (IARC, 1999) ラット ラットに63、125、250、500、1,000 mg/kg/day を5 日間/週×2 週間強制経口投与した実験で、500 mg/kg/day 以上で振戦、痙攣、死亡がみられ、1,000 mg/kg/day は全例が死亡している。5) (IPCS, 1994) ラットに7.5、15 mg/kg/day を6 日/週×40 日間強制経口投与した実験では、15 mg/kg/dayで赤血球の大小不同症、多染性、好酸性赤芽球等の血液学的変化がみられている。5) (IPCS, 1994) ラットに2.5、25、50 mg/kg/day を5 日間/週×1、3、6 週間強制経口投与した実験で、50mg/kg/day でアラニンアミノペプチダーゼ、アルカリ性フォスファターゼ、γ-GTP、N-アセチルグルコサミニダーゼの排泄増加がみられ、間質の炎症、変性/再生尿細管が多くみられている。また、近位尿細管の増殖活性が上昇している。5) (IPCS, 1994), 17) (IARC, 1999) ラットに5 %の濃度で9 週間混餌投与した実験で、顕著な体重減少、再生不良性貧血、骨髄細胞減少、脾臓のリンパ減少、肝細胞萎縮、脂肪組織萎縮、横紋筋萎縮、腺胃粘膜の潰瘍及び出血がみられている。5) (IPCS, 1994), 10) (Kari FW, 1989) ラットに5、10 mg/kg/day を4 ヵ月間強制経口投与した実験で、10 mg/kg/day に死亡がみられている。5) (IPCS, 1994) ラットに20、64、200 mg/kg/day を5 日/週×13 週間強制経口投与した実験で、64 mg/kg/day以上に振戦、運動低下、200 mg/kg/day で体重増加の抑制及び摂餌量の低下がみられ、NOELは20 mg/kg/day とされている。5) (IPCS, 1994) ラットに25、50、100、200、400 mg/kg/day を13 週間強制経口投与した実験で、100mg/kg/day 以上に肝臓相対重量の増加、200 mg/kg/day 以上に嗜眠、体重増加抑制、振戦、痙攣、前胃の炎症及び過形成、また尿細管上皮の変性及び再生、尿細管の萎縮及び拡張、尿円柱、糸球体硬化、間質線維化、慢性炎症などの腎症、さらには死亡がみられ、400mg/kg/day では全例死亡している。5)(IPCS, 1994), 17)(IARC, 1999) ラットに25、50 mg/kg/day を15 ヵ月間強制経口投与した実験で、雄は高用量群に腎臓及び肝臓の相対重量増加、用量に相関した腎症の程度の悪化がみられ、雌は高用量群にヘマトクリット値、ヘモグロビン濃度、赤血球数の減少がみられている。5)(IPCS, 1994) ラットに25、50 mg/kg/day を5 日/週×103 週間強制経口投与した実験で、50 mg/kg/dayで腎症の悪化がみられている。5) (IPCS, 1994), 10) (Kari FW, 1989),17)(IARC, 1999) イヌ イヌに100 mg/kg/day を26 週間混餌投与した実験では影響はみられていない。5)(IPCS, 1994) また、イヌに16 mg/kg/day を80 週間、あるいは1.6 mg/kg/day を31 週間、引き続き40 mg/kg/dayを49 週間混餌投与した実験では影響はみられていない。5)(IPCS, 1994) 経皮投与 マウス マウスに300、600、1,200、2,400、4,800 mg/kg/day を5 日間/週×2 週間投与した実験では影響はみられていない。5) (IPCS, 1994) ラット ラットに240、480、1,920、3,840 mg/kg/day を5 日間/週×2 週間投与した実験で、3,840mg/kg/day で体重の低値がみられている。5) (IPCS, 1994), 10) (Kari FW, 1989) ■遺伝毒性 (link to CCRIS) (link to GENE-TOX) 一般的なネズミチフス菌で試験されたHQは、SOS修復を誘発せず、突然変異体数を増加させなかった。しかし、ネズミチフス菌TA104株及びTA102株では突然変異性であることが示された。これらTA104株及びTA102株は酸化型変異原物質と反応しやすい。TA104株で示された活性は、スーパーオキシドジスムターゼとカタラーゼの併用培養(co-incubation)によってほとんど完全に抑制されており、変異原物質であるスーパーオキシド及び過酸化水素の結果と一致している。マウス骨髄を用いたいくつかの生体内研究でHQは、小核及び染色体異常を誘発したが、姉妹染色分体交換は誘発しなかった。倍数性でない高倍数性及び染色体喪失(動原体陽性小核によって示された)もマウス骨髄で認められた。マウスの精母細胞で染色体異常及び高倍数性が観察された。HQは出芽酵母において遺伝子変換及び突然変異を誘発した。キイロショウジョウバエでは伴性劣性致死突然変異を誘発しなかった。試験管内ヒト細胞で、DNA単鎖切断の誘発はCu(Ⅱ)の存在に依存していることが示された。HQは、外因性代謝経路を用いなくても姉妹染色分体交換及び染色体異常を誘発した。動原体陽性小核がみられるヒトリンパ球を用いた小核誘発において代謝活性化経路は必要なかった。17) (IARC, 1999) Ames試験: ヒドロノキンは、ネズミチフス菌TA98、TA100、TA1535又はTA1537で外因性代謝活性化の有無に関わらず突然変異原性を示さなかった。10) (Kari FW, 1989) V79細胞(チャイニーズハムスターの胚細胞の培養細胞)における小核試験: HQ及びTBHQ(tert-butyl-hydroquinone)がプロスタグランジンH合成酵素を有するV79細胞において染色体の欠損や切断を発生する小核誘発機序は、細胞分裂阻害を利用したCREST染色(キネトコア抗体を用いる動原体染色)小核試験で研究されている。染色体欠損の指標となるCREST陽性小核及び染色体切断の指標となるCREST陰性小核の頻度はHQ及びTBHQの暴露後に上昇した。HQによる小核の形成はプロスタグランジンH合成酵素活性の指標となるアラキドン酸補給に依存していたが、TBHQのそれは依存していなかった。HQの酸化が酸素ラジカル体を生成することから、HQ及びTBHQにより生成された酸素ラジカル体が染色体障害の原因となった。ハイポキサチン及びキサンチンオキシダーゼを含めたスーパーオキシド生成システムがある場合には、小核保有細胞の頻度は上昇した。CREST陰性小核の形成はカタラーゼによる前処置で完全に抑制された。さらに、グルタチオン処置はCREST陽性及び陰性小核の両方を抑制した。これらの成績は染色体欠損と染色体切断がHQ及びTBHQにより誘発されることを示した。反応性の酸素分子種はHQ及びTBHQによる染色体切断の原因となるが、染色体欠損はキノン代謝産物が紡錘形成を障害する作用機序よると考えられる。18) (Dobo et al., 1994) マウスにおける小核試験: マウスにHQ 0、0.78、0.56、3.125、6.25、12.5、25、50、75 及び100 mg/kgで投与し、投与12, 24 及び36 時間後に骨髄内赤血球における小核の頻度、すなわち小核を有する多染性赤血球(MPCE)及び小核を有する正染性赤血球(MNCE)を計測した。MPCE及びMNCEの頻度はともにHQ用量に応じて上昇した。MPCE頻度はHQ 3.125mg/kg投与後24時間が最も高かった。同様に、MNCEの頻度の顕著な増加は、HQ 12.5mg/kg投与後に観察された。HQ用量に応じた小核頻度はMPCE頻度では直線的に上昇し、MNCE頻度で二次曲線的に上昇した。多染性赤血球(PCE)と正染性赤血球(NCE)との比は非薬剤処置の対照群と比して有意に下降した。PCE/NCE比はHQ投与12、 24 及び36 時間後の全て時期において、用量に応じて二次曲線的に減少した。19) (Jagetia et al., 1997) ヒトリンパ球培養細胞における小核及び姉妹染色分体交換の頻度とGSTM1遺伝子型の関係: HQは多くの食品で検出される骨髄毒素であり、ベンゼンの代謝によっても形成される。ヒトのベンゼン暴露は骨髄異形成症候群及び急性骨髄性白血病の進行と関連している。HQはいくつかの試験管内及び生体内試験において、小核、姉妹染色分体交換、染色体異常を誘発する遺伝毒性作用を示した。グルタチオンSトランスフェラーゼは、反応性化学中間体の水溶性形態への接合に関係する多型性酵素のスーパーファミリーである。これらの酵素は、内因性及び外因性化合物の解毒において重要な役割を果たし、多型遺伝子であるGSTM1、GSTT1、及びGSTP1がいくつかの遺伝毒物の特異的な代謝に関連していた。本研究ではヒトリンパ球を用い、HQによって誘発された小核及び姉妹染色分体交換頻度におけるGSTM1、GSTT1、GSTP1の遺伝子多型性に対する影響について評価を行った。15名の非喫煙者からリンパ球を採取し、GSTM1、GSTT1、GSTP1遺伝子型を同定した。リンパ球をHQ添加培地で培養すると、小核及び姉妹染色分体交換全体の頻度が顕著に上昇した(P<0.0001)。GSTM1遺伝子null型のリンパ球はGSTM1遺伝子発現型のリンパ球よりも、著しく高い小核発現頻度を示した(P=0.013)。対照的に、GSTM1遺伝子はHQ誘発性の姉妹染色分体交換頻度において影響しなかった。GSTT1及びGSTP1の遺伝子多型は、小核及び姉妹染色分体交換頻度には特別な影響はみられなかった。これらの結果は、GSTM1遺伝子がHQの代謝経路に関連することを示唆し、またGSTM1遺伝子多型がHQ化合物暴露によるDNA損傷に対する感受性の個人差に関係しているかもしれないことを示唆している。20) (Silva et al., 2004) ヒトリンパ球培養細胞に対してHQは染色体異常を誘発しない: ヒトリンパ球を用いて、試験管内での外因性代謝活性の存在下あるいは非存在下においてHQの構造的染色体異常を誘発する能力を調べた。さらに、HQが発癌抑制作用も有すると推定されていることから、過酸化物による染色体異常誘発に対するHQ前処理の影響も調べた。HQは細胞毒性を持つが、試験管内で培養されたヒトリンパ球には染色体異常を誘発しなかった。その上、HQ前処置されたリンパ球では、H2O2染色体異常誘発はHQの用量に依存して低下した(P=0.069)。しかし、この効果はH2O2の12 mM濃度でのみ出現し、高い細胞毒性があった。21) (Roza et al., 2003) ヒト白血球細胞の培養系におけるDNAコメットアッセイ: ヒト白血球細胞におけるHQの遺伝毒性をアルカリ性の単細胞ゲル電気泳動法(SCGE: コメットアッセイ)で調べた。リンパ球にHQ 0.5-50μg/mlを暴露するとDNA移動距離が用量依存性に長くなった。一方、全血液サンプルにHQ 100-500 μg /mlを暴露した後の白血球におけるDNA障害の誘発は観察されなかった。同じような差異がH2O2 50 μM処置された全血液サンプルとリンパ球との間にDNA損傷でも観察された。HQのDNA障害活性は外因性カタラーゼ 250 U/mlによって有意に抑制された(p<0.001、U-test)。このことは過酸化物生成がHQ遺伝毒性作用発現に関わることを示唆している。標準SCGE法とHQ処置前に細胞溶解を行う無細胞法を用いた平行試験はほとんど同じような結果を示したことから、HQ酸化作用に内因性代謝が必要でないことを示唆している。これらの結果は、HQがヒトリンパ球におけるSCGE法では強いDNA障害を引き起こすが、細胞遺伝試験では比較的低い反応性であったことを示している。22)(Andreoli et al., 1999) 既存化学物質安全性(ハザード)評価シート8) (経済産業省, 2000) 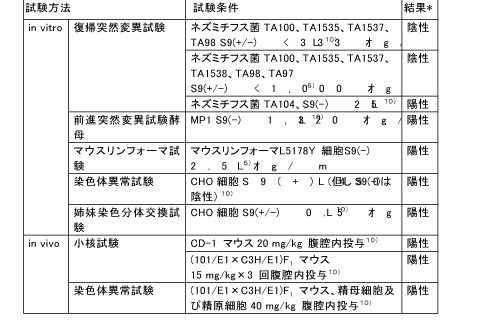
5)(IPCS, 1994), 10)(Kari FW, 1989) ■がん原性 (link to CCRIS) ヒトにおけるHQ発癌性については十分な証拠がない。実験動物においてわずかな証拠があるのみである。HQはヒトに対する発癌性物質であると分類されていない(Group 3)。 マウスにおける経口投与による癌原性試験において、HQは雌の肝細胞腺腫を誘発し、雄では腎細管腺腫を誘発した。 ラットにおける経口投与による癌原性試験において、HQは、雄では肝細胞腺腫と腎細管腺腫を誘発し、一つ試験では食道腫瘍の多様性が増加し、もう1つの試験では腎細胞腫瘍の多様性が増加した。 ハムスターにおける経口投与による癌原性試験において、膵臓の発癌現象における促進作用は観察されなかった。 HQに長期間暴露していた労働者コホートの癌罹患率は、2つの比較人口と比べても低かった。理由は定かでない。HQを使用したことのある者を含む石版工コホートの5例で、悪性黒色腫過剰が発生していた。その内2例のみがHQへの暴露を報告していた。 17) (IARC, 1999) マウス 1群雌雄B6C3F1マウス(6週齢)に、0.8%HQ添加飼料を96週間給餌した。この投与により、腎尿細管過形成と腎細胞腺腫が発生し、その発生は雄に多かった。肝変異細胞巣の発生率は上昇し、特に雄の投与群において肝細胞腺腫も出現した。前胃の扁平上皮細胞過形成の発生率は対照群と比して投与群の雌雄で顕著に高かったが、それに平行する前胃の腫瘍の発生上昇は観察されなかった。本研究から、HQが雄の肝臓に発癌性を促進することを明らかにした。23) (Shibata et al., 1991) 1群雌雄各65匹のマウスに、HQ0, 50又は100 mg/kg含有の脱イオン水を5日/週、2年間強制経口投与した。中間観察として投与15ヶ月後、各群10匹を屠殺したところ、相対肝重量の増加が高用量群の雌雄に認められ、雌の群で対照群よりも大きかった。雄の肝臓では、肝細胞が合胞し、巨大化したものが増加していた。2年間の試験では、平均体重は投与93週後に、雄の高用量群では対照群より5-8%減少した。雌のそれでは、投与20週後に、対照群より5-14%減少した。相対肝重量は、雌雄の高投与群で増加していた。生存率には、いずれの群でも差はなかった(雄:33/55; 37/54; 36/55; 雌:37/55; 39/55; 36/55)。肝臓で、化合物に関連した病変は、雄の高用量群で核大小不同(0/55; 2/54; 12/55)、合胞体化(5/55; 3/54; 25/55)及び好塩基性肝細胞変異巣(2/55; 5/54; 11/55)であった。肝細胞腺腫の発生率は、雄の投与群で増加した(9/55; 21/54; 20/55)が、肝細胞癌の発生率は減少した(13/55; 11/54; 7/55)。雌の投与群では、肝細胞腫瘍の発生は主に腺腫であった(3/55; 16/55; 13/55)。甲状腺の濾胞細胞の過形成の発生率は、投与群で増加した(雄: 5/55; 15/53; 19/54; 雌: 13/55; 47/55; 45/55)。甲状腺の濾胞細胞腺腫も発生した(雄: 2/55; 1/53; 2/54; 雌: 3/55; 5/55; 6/55)。甲状腺の濾胞腺癌は、雌の高用量群で7/55に発生した。自然発生の甲状腺の濾胞腺腫と濾胞腺癌は、水を強制経口投与した雌のB6C3F1マウスで3/48(6%)であった。雄で発癌性はなかった。雌では肝細胞腫(特に腺腫)の発生増加が認められた。雌雄で甲状腺の濾胞細胞の過形成が発生し、及び雄では肝細胞の核大小不同、多核肝細胞及び好塩基性肝細胞変異巣が発生した。10) (Kari FW, 1989) ラット 1群雌雄各30匹の週齢6週のFischer 344ラットに、HQ(純性、>99%)0及び0.8%濃度含有食を、104週間強制経口給餌した。この投与により、腎尿細管過形成と腎細胞腺腫が発生し、その発生は雄に多く、慢性腎炎と関係していた。更に雄ラットでは、腎乳頭の上皮過形成が発現していた。肝臓変異細胞巣の発生率は顕著に減少していた。本研究から、HQが雄の腎臓に発癌性を促進することを明らかにした。23) (Shibata et al., 1991) 1群雌雄各65匹のFischer 344/Nラットに、HQ0, 25又は50 mg/kg含有の脱イオン水を5日/週、2年間強制経口投与した。中間観察として投与15ヶ月後、各群10匹を屠殺したところ、相対肝重量の増加が高用量群の雄に認められ、対照群よりも大きかった。雌の高用量群で、ヘマトクリット値、ヘモグロビン濃度及び赤血球数が減少した。雄では、HQに関連した腎症の重症化が認められた。2年間の試験では、平均体重は投与73-93週後に、雄の高用量群では対照群より5-9%減少し、その後に、10-13%減少した。雄の低用量群では89週後に対照群より5-9%減少した。雌の投与群では、対照群と比較して同じような平均体重であった。相対腎肝重量は、雄の高用量群で対照群よりも増加していた。対照群及び投与群のほとんど全ての雄と大部分の雌が腎症を発症した。雄の高用量群で腎症の重症度は大きかった。雄で、進行性腎疾患を伴う腎盂移行上皮及び腎皮質嚢胞の過形成の変化が増加していた。腎尿細管の過形成が雄の高用量群2匹に見られ、腎尿細管腺腫が、雄の低用量群で4/55、雄の高用量群で8/55に見られた。雌で、単核細胞白血病の陽性反応が見られ、投与群では対照群と比べて大きかった(対照群:9/55、低用量:15/55、高用量:22/55)。雌の水を強制経口投与した対照群における、白血病のHistorical incidenceは25%±15%であり、非投与の対照群では19%±7%であった。雄で腎尿細管細胞腺腫の顕著な増加や、雌で単核細胞白血病の増加に見られるような発癌性が認められた。10) (Kari FW, 1989) ■生殖発生毒性 (link to DART) 催奇形試験性におけるNOEL無影響量はラットでは100mg/kgであり24)(Krasavage et al., 1992) 、及びウサギでは75 mg/kg/日と推定される。25)(Murphy et al., 1992) 繁殖試験において一般的及び発生毒性におけるNOEL無影響量はそれぞれ15及び150 mg/kg/日であった。26)(Blacker et al., 1993) ラットにおける催奇形試験 1群各30匹のCrl: COBS CD(SD)BR妊娠ラットに、HQ0, 30, 100又は300 mg/kgを妊娠期間6-15日目まで強制経口投与した。生殖指数すなわち妊娠率、黄体数、着床部位、生育可能な胎児、早期及び後期吸収(early and late resorptions)、胎児の性別比、着床前及び着床後の喪失、妊娠後の子宮重量は、ヒドロキニンによる処置の影響を受けていなかった。300 mg/kg投与群において認められた胎児平均体重のわずかな減少は、同用量群の母獣における体重増加の減少と関連していた。肉眼的外部、内部軟組織及び胎児の骨格検査から、HQ関連性の奇形は明らかにされなかった。HQの投与を受けた同産子の肉眼的外部変異(小さな血腫)及び内部軟組織の変異(拡張型腎盂、水腎症、水尿管症)の発生率で、対照群の発生率との統計学的な差異は認められなかった。骨格変異(膜性頭蓋骨、舌骨、第1-3胸骨中心、及び第3と4仙骨弓における化骨遅延、並びに第9-13胸骨中心の二分裂)は対照群とHQ投与群で同様の頻度であった。HQ300 mg/kg投与群で認められた総合的、一般的な脊椎変異の発生率は、統計学的に顕著な上昇を示していたが、毒物学的には重大であると考えられなかった。対照群とヒドロノキン投与群とを比較した総合的骨格変異の発生率も、統計学的に差異を示さなかった。無作用量は100mg/kgと推定される。24)(Krasavage et al., 1992) ウサギにおける催奇形試験 1群雌雄各18匹(雌は妊娠中)のニュージーランド白ウサギで、妊娠期間6から8日目にHQを0, 25, 75又は150 mg含有する水溶液を強制経口投与した。妊娠期間30日目に帝王切開が行われた。150 mg/kg/day投与群の胎児における外面的、内臓的、骨格的所見の総合発生率は、対照群との比較においても、統計学的な差異は認められなかった。しかし、1胎児及び1同複子基準あたりの両方で、眼及びわずかな骨格奇形の発生率(微小眼炎、椎骨及び肋骨欠損、角化した舌弓)において、軽微で統計学的には重要でない上昇が見られた。本試験の状態下で母性毒性存在下のもと、HQ150 mg/kg/dayは、わずかな発育上の変異(developmental alteration)を引き起こした。発生毒性におけるNOEL:無影響量は75 mg/kg/dayであった。25) (Murphy et al., 1992) ラットにおける繁殖試験 ラットで、生殖能力におけるHQ暴露作用についての二世代試験を行った。3群各30匹のSprague-Dawleyラットに、HQ15, 50又は100 mg/kgを1日1回強制経口(F0グループ)投与した。F1及びF2の同腹子が、授乳期0, 4, 7, 14又は21日目に、数、性別、体重、子の肉眼的奇形の項目で評価された。試験の最後には、全ての親及び子の内部奇形が調べられた。結果、F0及びF1の150 mg/kg投与群で、一過性振戦にみられるわずかな親の毒性がみられた。投与群の雌における食料消費量、体重に影響は認められなかったが、F1の雄親の体重で統計学的な有意差が認められた。2世代にわたる生殖能力に悪影響は及ぼされていなかった。子の平均数及び生存能はF1とF2の同腹子で類似していた。誕生時及び授乳期に死亡した子の総数は0, 15, 50又は150 mg/kg/dayの投与群それぞれの同腹子F1で13, 13, 9, 10匹であり、同腹子F2では17, 13, 26, 23匹であった。出生後0日目、 F2の15又は50 mg/kg投与群における子の体重で顕著な増加が認められた。その後、タイムポイントごとの子の体重は対照群の体重と同等であった。HQは選択的な生殖毒物ではなく、一般的及び生殖毒性において無影響量はそれぞれ15及び150 mg/kg/dayとなる。26) (Blacker et al., 1993) 鶏卵における催奇形試験 培養72時間及び96時間後の鶏胚で、HQの発生毒性作用を調査した。1鶏卵あたりHQ0.0625-40 μgの用量を鶏卵の気嚢部分へ注入した。培養15日後、対照群も含め、生存している鶏胚が卵から取り除かれ、肉眼的奇形及び身体的出血が検査された。培養72時間及び96時間時のHQLD50値は1鶏卵あたり8.59及び15.63 μgであった。HQは両群において、1鶏卵あたり0.0625-20 μgの用量範囲で、発達途上の鶏胚における身体的出血、渦巻いた鉤つめ、外転した臓器、不完全なくちばし、脳ヘルニア、単眼症を引き起こした。両群における、様々なタイプの奇形及びその発生率は、対照群との比較でも高かったが、統計学上で有意を示すものではなかった。濃度の違いによる奇形の発生は、培養72時間及び96時間両群で35%以下であった。本研究の結果、HQは高用量で胚芽毒性を発し、催奇形に対しては顕著な作用を示さないことを示している。27)(Burgaz et al., 1994) ■局所刺激性 皮膚 モルモット 5)(IPCS, 1994) 黒色モルモットの除毛皮膚では、2% HQあるいは5% HQの油-水懸濁液を、毎日3週間、表面塗布して試験を行ったところ、脱色、炎症性変化、表皮の肥厚が発生した。5% HQ投与群で、著しい皮膚脱色が見られた。感受性は雄よりも雌の方が高かった。 黒モルモット8匹に,HQ 1, 3, 5, 7 及び10%含有バニシングクリームを脱毛及び非脱毛皮膚両方に塗布した。各用量別の動物数は報告されていなかった。対照群は6匹であった。1日1回、5回/週クリームの塗布を1ヶ月間行った。HQ5%以上のクリームで、そう痒が発生した。HQ含有クリームを塗布した部位全てで、軽度から中等度の色素脱失が発生した。28) (Bleehen et al., 1968) モルモット雌18匹にHQ(水0.1 ml中0.001、0.01 及び0.1% 含有)を10日間皮内投与したが、一次刺激原であるとは認められなかった。29) (Rajka et al., 1970) 黒モルモット雌雄24匹にHQを局所適用したところ、脱毛部位で色素脱色が報告された。油-水乳剤でHQの2%もしくは5%含有のクリームを毎日、6日/週を3週間に亘り適用した。8-10日の間に最初の色素脱失が見られ、14-20日の間に最も大きくなった。高濃度のクリームで、より顕著な色素脱失が見られた。炎症性変化及び表皮肥厚も報告された。3週間のHQ局所適用で、生検標本における細胞内のメラニン化したメラノソーム数及び、活発に機能するメラノサイト数両方で顕著な減少が引き起こされた。30) (Jimbow et al., 1974) モルモット8匹で行った予備スクリーニング試験で、HQ10%水溶液がわずかなそう痒を引き起こした。31) (Springborn Institute for Bioresearch, 1984)。 最近、黒モルモット雌雄で、HQが皮膚色素脱失及びそう痒を引き起こす可能性についての研究が行われた。研究の結果、雄よりも雌のほうが、より高い感受性を持つことが示された。ある動物で、雌雄各5匹づつにHQ0.1, 1.0, 及び 5.0%含有の親水軟膏0.1 mlを、背中の脱毛部位に5日/週、13週間に亘って投与した。HQ0.1%含有軟膏は、色素脱失を伴わない辺縁性そう痒を引き起こし、一方、HQ1.0%含有軟膏は、動物の30%(主に雌)でわずかなそう痒から辺縁性そう痒と、雌でわずかな色素脱失から乏しい色素脱失を引き起こした。HQ5.0%含有軟膏では、中等度から重度のそう痒及び、重度の潰瘍化炎症反応が発生した。中等度の色素脱失が投与群の約40%(雌のみ)で観察された。投与群の80-100%で色素過剰症が見られたが、HQ処置によるものであるとは考えられなかった。32) (Maibach et al., 1989) 眼刺激性 5) (IPCS, 1994) モルモット モルモットに粉末HQ1-3 mgを1日2回、9週間投与したところ、同じように即時型で一過性の炎症が発症した。投与2日の眼には、数匹のモルモットでわずかな角膜の混濁が観察され、投与3日の眼には程度の違いはあるが、ほとんどのモルモットで混濁が発症した。2匹でには潰瘍が発症した。HQ投与中止3日後、眼は完全に回復した。 ウサギ ウサギの角膜に、HQ(0.012-0.05 mol/litre)の0.1ml溶液(賦形剤は明記されず)を注入した後のresultant反応は、最高100の内、5を示していた(Hughes, 1948)。6群のウサギの眼に、より細かい粉末HQ(量は明記されず)を2-4ヶ月間毎日投与した。ウサギを、暗所、太陽光、標準光、紫外線照射、ヘマトポルフィリンによる前感作後に弱い光,もしくはヘマトポルフィリン前感作後に太陽光の6群に選別し収容した。ほとんどのウサギが結膜から角膜へと色素沈着を発症した。角膜実質の変性変化も観察された。色素形成は光へ暴露した群により早期に観察された。年齢の低いウサギより、高いウサギで色素沈着が発症しやすい傾向があるようだった。色素沈着は正常な色素のウサギと同じく、白子ウサギの眼にも発現した(Ferraris de Gaspare, 1949)。水溶液中のHQ(たとえば涙)は空気によって酸化され、部分的に1,4-ベンゾキノンへ変換されることから褐色を形成する(Grant, 1986)。HQ暴露による眼内部の障害は知られていない(Grant, 1986)。 イヌ イヌに、粉末HQ2-5 mgを1日2回、5日/週、9週間に亘って毎日点眼したところ、即時型で一過性の炎症及び流涙が発症した(Dreyer, 1940)。角膜の混濁、流涙、結膜の赤化が4日以内に発症したが、潰瘍は見られなかった。眼はHQ投与中止後2日以内に正常へ戻った。 既存化学物質安全性(ハザード)評価シート8)(経済産業省, 2000) モルモットを用いた実験で10%水溶液が皮膚刺激性を有することが報告されている。 イヌやモルモットの眼に本物質1-5 mg を反復点眼した実験で角膜の混濁などの刺激性反応が観察されている。また、ウサギの眼に0.1-0.5%溶液を0.1 mL 点眼した実験で弱い刺激性反応がみられている。5) (IPCS, 1994) ■その他の毒性 抗原性 モルモット 5) (IPCS, 1994) 感作試験は、その方法、或いは用いた媒体によって軽度から重度までの反応を表す。最も強い反応は、モルモットのmaximization testにおいて得られた。HQとp-メトキシフェノールとの間の、ほとんど100%に近い交叉感作が見られたが、p-フェニレンジアミン、スルファニル酸、p-ベンゾキノンとの交叉反応では、十分な証拠は得られなかった。29) (Rajka et al., 1970) 雌のモルモットにおけるHQの皮膚感作に関する調査がおこなわれた。HQ0.001%溶液で感作した後に「弱い」感受性を誘発されたHQを雌モルモットに皮内注射し、HQのequipotent溶液で負荷試験を行った。モルモットで、既知のヒト接触感作物質が検出できるかどうかの調査が行われた。Magnusson & Kligman maximization testによる検定では、HQ誘発の感作は「強い」とされ、single injection adjuvant testでは「中程度」、modified Draize procedureでは「弱い」との結果が出た(Goodwin et al., 1981)。 HQは、Van der Walle et al., (1982a,b)によって行われたモルモット感作性試験及びFreund's complete adjuvant testから、雌のモルモットで「中程度」の感作物質であると認められ、0.5 mol/litre及び0.45 μmol/litreの誘発濃度によるFreund's complete adjuvant testにおいて、同一の感作ポテンシャルを産出した。試験の結果、HQとp-メトキシフェノールの交差反応がほとんど100%であることが示された。HQとp-メトキシフェノールとも、アクリルモノマー中で、不必要な重合作用を防ぐ抑制因子として使用される。33),34) (Van der Walle et al., 1982a,b) 最近、Basketter & Goodwin (1988)は局所及び皮内経路適用から成る3つの感作検査法を用いた。モルモット10匹を、モルモットmaximization test、modified single injection adjuvant test、a cumulative contact enhancement testで感作した。HQの感作ポテンシャルは、各テストごとに「強い」、「弱い」、「中程度」と評価された。続いて行われた、p-フェニレンジアミン、スルファニル酸、p-ベンゾキノンによるcross-challengeでは、交差反応に関する「限られた証拠」しか認められなかった。 35)(Basketter et al., 1988) 代謝 マウス 1群6匹以上の6週齢のB6C3F1マウスに、HQの95%エタノール溶液中 (0.2ml)の0, 2(1動物あたり4 mg)又は20%(1動物あたり40 mg)を継続して3日間、肩甲骨間に皮膚塗布した。投与開始後、マウスを独立した代謝ケージへ入れ、第1回目の投与から2, 8, 24, 48および72時間後に尿サンプルを採取した。雄の投与群で、投与2-72時間後の尿中にHQが検出された。高用量群の皮膚にHQの結晶が見られた。 10) (Kari FW, 1989) ラット この研究の目的は,生体内で雄ネズミの肺でのヒドロキノン(HQ)吸収と初回通過代謝の割合と範囲を調査することであった。 生理食塩水に混合した[14C] HQは,HQ微粉末の吸入暴露をシミュレートするために,チューブを気管内に留置して投与した。 HQの生物学的利用能は,投与直後に意識のあるネズミから,動脈と静脈から同時に血液サンプルを抽出して決定した。 肺の吸収と代謝,全身の代謝および排泄は,[14C]HQの気管内投与後に血液サンプル0.1,1.0,および10mg/kgで親化合物と代謝物質のクロマトグラフ分析により決定した。 HQの肺の吸収は,投与の5から10秒後に動脈血と,それより少量であるが静脈血で,非常に短時間内に[14C]HQとして検出された。 [14C]HQのみが,初期(5-10 秒後)の動脈血サンプルからすべての投与量レベルで検出された。 このことはHQの肺での代謝がそれほど多くなかったことを示している。 しかしながら,その後の血液サンプル(45-720秒後)は,気管内吸収後の親化合物と代謝物質の急速な代謝と排泄を示した。 0.1mg/kg投与量からの排泄半減期は,人の比率に換算し,,定常状態(最大)の人のHQ血中濃度の概算に使用した。 この概算は,1時間以上の0.1mgか2.0mg/m3でのHQによる呼吸暴露後の,最小限の人の血中HQ濃度を示した; このHQ濃度は以前の研究で人の血液で検出されたバックグラウンド濃度よりも低かった。36) (Deisinger PJ, et al., 1999) HQは産業および商業において広く使用されているが,低い毒性があると考えられている。HQの代謝はこれまでに研究されているが,完全な物質収支は報告されていない。 我々はHQ未投与,およびHQ前投与した雄Sprague-Dawleyラットを用いてHQの代謝を研究した。 [14C]HQは5,30または200 mg/kgを強制投与による単回投与を行った。単回投与に続いて200 mg/kg投与雄ラットに,200 mg/kgの[14C]HQを4日間,強制投与で反復投与した。 別の研究では,ラットは2日間5.6%の標識されていないHQか,または強制投与で311mg/kgの[14C]HQを投与した。 単独または反復投与したラットでは,[14C]HQの排泄パターンとその代謝物質は類似していた。 200mg/kgの[14C]HQ単回投与ラットでは,2-4日以内に尿中に91.9%が排泄された; 3.8%は糞中に排泄され,およそ0.4%は呼気に排泄され, 1.2%は体内にあった。放射能活性は組織中に広く分布しており,肝臓と腎臓で比較的高かった。 組織中の14Cの減少は48時間から始まり96時間目までだった。 尿中の標識化合物は,HQ(投与量の1.1-8.6%),ヒドロキノンモノ硫酸塩(25-42%),およびヒドロキノンモノグルクロニド(56-66%)だった。同様の研究結果は食餌中にHQを投与したラットで観察された。 200mg/kgのHQ反復投与ラットでは,コントロール群との比較において,絶対的相対的肝臓重量,肝臓ミクロソームタンパク濃度,b-5シトクロムP-450活性,またはシトクロムc還元酵素活性について,有意な増加傾向はなかった。 HQを反復投与したラットではコントロール群との比較において,シトクロムP-450の値はでわずかではあるが,有意に減少していた。37)(Divincenzo GD et al., 1984) [U-14C] ヒドロキノン(HQ)を1群5匹のF344雄ラットに5,25または50 mg/kgを強制単回経口投与し,HQの代謝を検討した。 ラットを代謝ケージに収容し,尿,糞および呼気を8時間後及び24時間後に採取した。 24時間の採取後にラットを屠殺し,測定する組織を摘出した。 全用量群でラットは,HQを急速に吸収し急速に排泄した。主な排泄経路は尿であった。 投与8時間後,用量の61.8-63.9%がHQグルクロニドとして,19.1-26.2%が硫酸HQ(エーテル)として,0.6-1.4%がHQ未変化体で排泄された。 尿中代謝産物比は用量に依存していなかった。投与24時間後,用量の93%以上が尿中から,1.2-3.5%が糞中から,0.12-0.16%が呼気14-CO2として検出された。採取組織や屠体からも,微量の放射能活性が検出された。各用量群における平均放射能回収率は用量の97%以上であった。38) (Kodak, 1984) 1群6匹以上、6週齢のF344/Nラットに、95%エタノール中HQ(0.2ml)の0, 2(1動物あたり4 mg)又は20%(1動物あたり40 mg)を継続して3日間、肩甲骨間に皮膚塗布した。投与開始後、ラットを独立した代謝ケージへ入れ、第1回目の投与から2, 8, 24, 48又は72時間後に尿サンプルを採取した。雄の投与群から、投与2-72時間後の尿中にHQが検出された。高用量群の皮膚にHQの結晶が見られた。10) (Kari FW, 1989) その他 HQの生態毒性学的挙動は、光への感受性、pH、溶存酸素を誘発する物理化学 的特性に関連している。その総じて高い生態毒性(すなわち、水生生物類に対して1mg/L以下)は、生物の種類により変化する。藻類、酵母類、真菌類、植物類のHQに対する感受性は、一般に毒性試験に用いられる他の生物類よりは低い。しかし、分類学上同一のグループにおいて、種々の生物のHQに対する感受性は1,000倍の変化を示す。5) (IPCS, 1994) ヒト骨髄系の細胞株のML-1及びHL-60で、ベンゼン代謝産物であるHQの毒性を検討した。HQによる処置は、これら2つの骨髄系細胞株における細胞増殖の抑制及び細胞生存能の喪失を引き起こした。また、細胞グルタチオンの顕著な減少も引き起こし、この減少は細胞生存能の喪失に先行して発現した。グルタチオン生合成の阻害剤であるブチオニンスルホキシミンによるこれら細胞株への前処置は、HQ誘発毒性を顕著に増加させた。一方、キノンレダクターゼ阻害剤の前処置は、ML-1ではHQ誘発毒性を増加させなかった。更に1,2-dithiole-3-thioneによる前処置は、HQ誘発細胞増殖及び細胞死を顕著に抑制した。これらの結果から、骨髄系細胞におけるHQの毒物力学では、キノンレダクターゼでなくグルタチオンが重要な因子であると考えられる。39)(Li et al., 1994) ■ヒトにおける知見 (link to HSDB) 誤用 HQ 1gの摂取で、耳鳴、悪心、嘔吐、窒息感、息切れ、チアノーゼ、痙攣、せん妄、虚脱が発症した。5gの摂取は死亡を招いた。経口摂取は腸管の炎症を引き起こす。皮膚接触によっては皮膚炎が起こり得る。40)(Deichmann WB et al., 1981) 自動写真現像機を操作している54歳男性が、手、前腕、胸部に、湿疹性及び苔癬様の痒みを伴う皮疹を発症した。組織学的検査の結果、リンパ球の海綿状態及びエキソサイトーシスを呈した湿疹や、基底細胞の液状化現象壊死を呈した扁平苔癬、隣接する基底膜及びコロイド体形成における単核細胞浸潤の特徴が見られた。加えて独立したケラチノサイト壊死もあった。現像液(3-methyl-4-amino-n-diethyl aniline hydrochloride)及び現像機の色として使用された化学物質part3の1%溶液が強い陽性反応を示した。発疹はその後6ヶ月間続いたが、現像機の換気を良くし、呼吸フィルターやPVC手袋を装着したところかなり改善した。その後6ヶ月間、胸部と手首に時折表れる丘疹を除いた部分の皮膚は綺麗なままであった。初めての来院から1年後、はっきりとした境界を持つ色素脱失が、手や手首の甲、及び口の周囲に表れた。自己免疫疾患の個人歴や家族歴はなく、検査でも自己免疫障害の証拠は見つからなかった。免疫学的スクリーニングで、陽性反応を示す微量の胃壁細胞抗体が認められたにも関わらず、患者の血清ビタミンB12濃度は正常であった。41) (Kersey et al., 1981) その他 ヒトにおける症状: 目のかゆみ、結膜炎、角膜炎(角膜の炎症)、中枢神経興奮、着色尿、悪心、眩暈、窒息、呼吸促迫、筋攣縮、せん妄、虚脱、皮膚過敏、感作、皮膚炎。標的臓器:眼、皮膚、呼吸系、中枢神経系。42) (NIOSH, 2003) ヒドロキノン 安全性(MSDS)データ: 発癌性物質の可能性有り。重症な皮膚刺激物:アレルゲン。吸入及び経口摂取により有害。感作を引き起こす可能性有り。眼及び呼吸刺激物。 リスクに関する警句 R20:吸入すると有害性がある。R22:飲み下すと有害性がある。環境上の注意 水生生物に強い毒性がある。輸送上の注意 UN No 2662。危険クラス:6.1。包装等級:Ⅲ。暴露防止措置 保護メガネ、手袋、十分な換気。発癌物質の可能性があることに留意して取り扱うこと。安全性に関する警句 S24:皮膚への接触は避けること。S25:眼への接触は避けること。S39:眼/顔の防護具を着用のこと。43) (The Physical and Theoretical Chemistry Laboratory, Oxford University Chemical and Other Safety Information, 2004) 空気中、土壌中、水中のHQ濃度のデータはない。しかし、HQはフィルターなしのシガレットの主流煙中に、シガレット1本当り110~300μgの範囲で測定され、また副流煙にも含まれている。HQは植物から製造された食品(例えば小麦の胚芽)、沸かしたコーヒー、ある種のイチゴの葉で調製された茶類中でも見出され、その濃度は時には1%を越している。 写真愛好家は、HQに皮膚あるいは吸入により暴露されることがあり得る。しかし、暴露濃度についてのデータは入手できない。5) (IPCS, 1994) 経口: 男性2名にHQ500 mgを毎日、5ヶ月間服用した。男女各17名にHQ300 mg/dayを3-5ヶ月間投与した。HQは1日3回の食事に分割して投与した。1ヶ月の統制期間及び実験期間中、血液中のヘモグロビン比率、ヘマトクリットもしくは赤血球細胞数、白血球分類、沈降率、血小板数、凝固時間及び黄疸指数を分析した。尿検査として、アルブミン、還元糖、白及び赤血球数、円柱及びウロビリノーゲンを測定した。検査の結果、合計19名の尿及び血液で異常は見られなかった。16) (Carlson et al., 1953) 吸入: HQ及びメチオニン暴露後の呼吸器系の疾患の兆候が報告された。同じ化学品工場に勤務する103名が、暴露の程度によって3群へ選別され、質問書、メタコリンとサルブタモール負荷による呼吸機能試験、血清免疫グロブリンG及びE測定によって比較された。H群の33名はHQ、トリメチルHQ、レチネンHQに暴露していた。M群の15名はメチオニンに暴露していた。C群の55名は対照群であった。呼吸器系の症状の有病率は、暴露群の2群で高値を示した。負荷試験前の肺機能値は、C群との比較においてH及びM群で顕著な低値を示していた。負荷により、3群間において顕著な変動を誘発したが、これらの変動は他群との比較では、M群で少なかった。H群(m±SD=12.5 g/l±2.6 )における免疫グロブリンG濃度は、C群(10.6 g/l±2.4;P<0.002)よりも顕著に高かった。H群における免疫グロブリンE濃度( m=140 IU/L)も、C群よりも高かった(109 IU/L)が、有意差はなかった。これらの結果は、おそらく免疫学的作用機序により、メチオニン、HQ及びその誘導体への暴露が呼吸器系の障害を誘発していることを示唆している。44)(Choudat et al., 1988) 刺激性 眼障害 HQと大気中キノン濃度の複合暴露は、眼の刺激、光への過敏性、角膜上皮の傷害、角膜潰瘍、視覚障害を生じさせる。また、多少の視力喪失の事例も存在する。刺激は、2.25mg/m3 以上の暴露濃度において起こった。長期暴露では、結膜および角膜の着色と混濁も生じさせた。角膜と結膜の徐々に進展する炎症と変色は、HQ0.05~14.4mg/m3に、少なくとも2年間毎日暴露されることで発生し、重症例は5年以上あとでも発生しなかった。HQの暴露中止数年後に生じた角膜傷害が1件報告されている。5) (IPCS, 1994) 長年HQ製造に携わってきた労働者において、目に入った無色なHQの粉塵(眼瞼裂からによる)が褐色のベンゾキノンへ酸化する。このHQの粉塵は、角膜上皮の基底層内もしくはその近辺にある大顆粒及びより表面に近い上皮の小顆粒で貯蔵される。この酸化は、褐色の帯状角膜症として可視的である。45) (Anderson B, 1947) 労働者が、全身作用を及ぼすほど高値ではない蒸気濃度(HQ)に長時間暴露すると角膜の着色及び混濁が発症した。40) (Deichmann WB et al., 1981) 口腔粘膜 34歳女性が2-3ヶ月にわたる口唇炎を訴え病院へ訪れた。過去1年間、患者は金属成分を含まないアクリル製の義歯を上下顎に装着していた。患者は義歯を装着している時のみに感じる口蓋の灼熱感をも訴えていた。患者はクロルヘキシジンを含んだ防腐性うがい薬を使用しており、ニッケルアレルギーを持っていたが、アトピー性ではなかった。GPEDC標準シリーズ、歯科シリーズ、使用しているうがい薬によるパッチテストを行い、テスト2日目と4日目の結果が観察された。患者は、ニッケル、コバルト、パラジウム、メチルHQで陽性反応を示した。パッチテスト中患者の唇の病変部に、急性口内炎症反応に関連する重度の腫れが発現した。舌及び下唇と歯肉内部表面のびらんを伴う舌炎及び口内炎が観察された。嚥下も困難であり、口内に灼熱感があった。義歯に使用された液体及び粉末を歯科義歯製造業者から取り寄せた。義歯はイタリアから輸入されており、Ruthinium Denal Manufacturingより供給されていた。薄層クロマトグラフィーによる検査が行われ、液体中にHQが含まれていることが判明した。患者の義歯を他の義歯に取り替えたところ、症状は顕著に改善した。46)(Torres et al., 1993) 皮膚 種々の人種の男性ボランティアにおける、各種基剤中に含まれるHQ3%以下の濃度の皮膚適用で、ごくわずかな影響が生じた。しかし、HQを2%含む皮膚脱色クリームが、白斑および組織褐変症を発症させることを示唆する症例報告もある。HQ(1%水溶液あるいは5%クリーム)は刺激(紅斑あるいは着色)を生じさせる。また、HQによるアレルギー性接触皮膚炎も診断されている。5) (IPCS, 1994) 経皮暴露は、HQを含む化粧品や皮膚脱色剤(skin lighteners)でも起こる。EC諸国は、その化粧品への使用を2%以下に制限している。米国においては、食品医薬品局(FDA)が、皮膚脱色剤の使用を1.5~2%の濃度と提案している。4%までの濃度が、調剤薬品中に検出されるであろう。一部の国では、より高濃度が皮膚脱色剤中に見出されるであろう。 HQに対する産業衛生上のモニタリング・データは極めて少ない。HQの製造および加工過程における空気中の平均濃度は0.13~0.79mg/m3の範囲と報告されている。各国における職業上の空気暴露限界(時間荷重平均)は0.5~2mg/m3の範囲である。5) (IPCS, 1994) 47歳女性が炎症後色素過剰症を防止する皮膚剥脱(グリコール酸70%)を受けた後、HQ5%及びグリコール酸10%含有の漂白クリームを毎日塗布するよう指示を受けた。7日後、クリームを塗った側の顔面に紅斑及び小胞性そう痒性班が発生し、その後かさぶた状になった。局所コルチコステロイドによる治療が行われ、漂白クリームは中止となった。15日後、病巣は消失した。患者の上背部で、GEIDC標準シリーズである化粧品バッテリー、使用中の漂白クリーム、HQ1%含有ワセリンによるのパッチテストを行った。TRUE test(Pharmacia, Hillerod, Denmark)及びLeukotest(BDF, Hamburg, Germany)を使用した。パッチテストの測定は、ICDRGスコアーを用い、48時間目及び96時間目に行われた。テストの結果、漂白クリームは++、HQは+であることが判明した。47) (Barrientos N et al., 2001) CLARIPEL TM CREAM With Sunscreens(Hydroquinone USP, 4%)48)(PDR, 2004) Ⅴ. 禁忌 過去にHQ又はその他薬剤で、過敏症又はアレルギー反応の既往歴のある患者。妊娠中又は子供(12歳以下)のHQ局所使用における安全性は確立されていない。 Ⅵ. 警告 A. 注意:HQは脱色剤であり、定められた用法、用量以外で適用すると、好ましくない美容効果を引き起こすおそれがある。医師は処方又は投薬の前に、HQの内容について周知するすべきである。 B. 使用前に、皮膚の一部分へ本剤を少量塗布して皮膚刺激感応性テストを行い、24時間以内に確認を行う。小さな発赤は禁忌部位ではないが、そう痒、小水疱形成、過度の炎症性反応が発症した部位への塗布は避けるべきである。その後の充分な観察が必要である。眼への接触は避けるべきである。使用後2ヶ月たっても脱色効果が表れない場合は、使用を中止すべきである。本剤は皮膚異常脱色の用途に限定し、日焼け防止剤として使用すべきではない。 C. 色素細胞の活性は微量の太陽光でも維持されるので、HQ治療中は日焼け止め剤を使用する必要がある。本剤に配合されている日焼け止め剤によって、HQ治療中の太陽光を遮ることが出来る。本剤使用中及び使用後はできるだけ太陽光を避け、本剤塗布部位を衣服で覆い、色素沈着の再発を防ぐべきである。 D. 本剤は小児の手の届かない場所に保存すること。誤飲してしまった場合はすぐに、医師もしくは中毒事故管理センターへ連絡すること。 E. 警告:本剤に含有されているメタ重亜硫酸ナトリウムのような亜硫酸塩剤は、薬剤に過敏な患者では、アナフィラキシー症状及び生命を脅かすようなアレルギー型反応もしくは中等度の喘息症状を引き起こす恐れがある。人口における亜硫酸塩剤過敏症の占める割合は不明であり、恐らく低いと思われる。亜硫酸塩剤過敏症は喘息でない人よりも喘息患者で頻繁に見られる。 F. まれに、皮膚が徐々にに濃い藍色へ変色することがある。このような場合、本剤の使用を中止し、すぐに医師へ相談すること。 Ⅶ. 使用上の注意 警告を参照 A. 薬剤胎児危険度分類基準C:局所HQで動物の生殖試験は行われていない。HQを妊婦へ局所使用した場合、胎児に害を与えるか、もしくはHQが生殖能力に影響を与えるかも不明である。HQの局所使用が全身に吸収されるのか、吸収された場合どの程度にまで及ぶのかも不明である。妊婦へのHQの局所使用は、明確な必要性がある場合のみ行われるべきである。 B. 授乳期間中の母親:HQの局所使用が、ヒトの母乳へ吸収、排泄されるかは不明である。授乳期間中の母親がHQを使用する場合は注意が必要である。 C. 小児への使用:12歳以下の小児患者における安全性及び有効性は確立されていない。 Ⅷ. 副作用 全身反応は報告されていない。偶発的な皮膚過敏症(局所的接触皮膚炎)が発症する可能性がある。発症した場合は、薬剤の投与を中止し、すぐに医師へ相談すること。 Ⅸ. 過量投与 HQ局所使用の過量投与による全身反応は報告されていない。しかし、使用前には認められなかった一過性の皮膚発赤及び中等度の灼熱感を起こした患者も存在するので、1度に塗布する領域はできるだけ最小にとどめるべきである。 肝斑患者30名において、HQもしくは美白剤を半分の顔面に、プラセボをもう一方の顔面に局所使用し、色素沈着過剰症の臨床的回復を調査した2重盲検無作為プ化ロスペクティブ研究。本研究は、2000年11月から2001年3月までの間、サンパウロ連邦大学のEscola Paulista de medicinaにおいて行われた。30名の患者は2群へ選別され、3チューブのクリームを受け取った。1群は夜間用に片側の顔面ずつに塗布するHQ4%含有クリームとプラセボ含有クリーム及び日中用に標準日焼け止めクリーム(SPF 25:太陽光線保護指数 25)を、もう1群は夜間用に片側の顔面ずつに塗布する美白合成薬剤5%含有クリームとプラセボ含有クリーム及び日中用に標準日焼け止めクリーム(SPF 25:太陽光線保護指数 25)を与えられた。全てのチューブは同じ外観をしており、クリームの特徴も同じであった。それぞれの患者の、顔面のどの半面にどのクリームが使用されているかを知りえたのは薬剤師1人であった。クリーム塗布前と塗布後の写真が、プロの写真家によって撮影され、その後クリームの塗布は3ヶ月間継続した。臨床的評価が2名の独立した観察者と患者自身によって行われた。統計学的評価はカイ2乗及びカッパテストによって行われた。試験を完遂した患者は25名だった。プラセボと比較して、全体で72%の改善が認められた。HQ投与群の改善率は76.9%であり、副作用率は25%だった。美白剤投与群の回復率は66.7%であり、副作用率は0%だった。結論として、肝斑治療においてHQ及び美白剤の両方が有用であった。HQ投与群は美白剤群との比較で、より効果的だった。患者がフィッツパトリックの皮膚分類でⅣからⅥのタイプを示し、試験が夏に行われたことを考慮すると、肝斑治療には美白剤のほうが優れた選択肢と思われる。49) (Haddad AL et al., 2003) 低用量HQ含有の漂白クリームによる接触白斑は稀にしか発症しないが、有害であり、性質がアレルギー性でないことから標準の閉鎖法パッチテストでは判明しない。HQ漂白クリームによって白斑を発症した患者の何名かでは、前症状である炎症、もしくはHQ1%含有のワセリン塗布72時間後の陽性パッチテスト反応が見られなかった。1名の患者で、HQ1%含有のワセリンを一部分に塗布してオープンテストを行ったところ、正常な皮膚で色素脱失が認められた。これらの所見から、色素脱失作用がアレルギー性のものでなく毒性性質によるものであることが示唆される。FDA諮問検討委員会は、HQ含有1.5-2.0%の一般用医薬品漂白クリームは処方箋なしで入手可能であると評価している。Arndt及びFitzpatrickがHQ2%含有クリームは、5%含有クリームと同様に治療効果があるが、副作用を引き起こすと評価したことにも注目すべきである。50) (Fisher., 1998) 9ヶ月前から頬及び眼窩周囲に肝斑が発症していた45歳女性は、HQ2%含有のクリームを局所塗布していた。HQ使用開始直後、いくらかの改善は見られたものの、痒みを伴う紅斑が塗布部位に発症した。患者はすぐにクリームの使用を中止したものの、その後使用を再開した。その後、奇異性色素過剰症が観察され、急速に黒ずんでいったため病院を訪れた。臨床的にその皮膚反応は外因性組織褐変症と一致していた。患者は標準の薬剤、化粧品、媒介物、HQ1%含有ワセリンによるパッチテストを受けた。パッチテストD2及びD4の2つでアレルギー反応(++)が認められた。1つはHQであり、もうひとつは他のパラフェニレンジアミン混合剤であった。HQに対する、アレルギー性接触過敏症関連の奇異性色素過剰症はまれな症状である。炎症はおそらくアレルギー性反応によって発現し、2次的作用として色素過剰症が発症したと推測された。その後患者は、局所レチノイン酸0.05%と高いSPF値の日焼け止め剤による新たな局所処置によって顕著に回復した。51) (Camarasa et al., 1994) ヒト角質層を用いたHQ5%水溶液の試験管内試験における経皮吸収率は、ラットの全層皮膚の吸収率と比較しても、およそ半分であった。ヒトの皮膚浸透率は「遅い」と分類された。52) (Barber et al., 1995) 第1症例: 1981年8月、3ヶ月前から指の爪が褐色へ変化している69歳女性が病院を訪れた。爪の変化は患者のイスラエル旅行、滞在5週目に始まった。患者の爪に異変が現れる前、8週間の間、光線性ほくろ防止用の美白クリームを手の甲へ1日2回塗布していた。使用したクリームは、Esoterica(Mitchum-Thayer Ltd)とFade-Out(Coparel Ltd)であった。検査の結果、指の爪全ての遠位及び近位面に血の気のない褐色の変色が認められた。美白クリームの使用を中止して2ヶ月後、爪の変色は回復した。53) (Mann et al., 1983) 第2症例: 1981年11月、指の爪が褐色へ変化していると訴える57歳女性が病院を訪れた。爪の変化は1980年3月に発症し、同年10月に回復したが、1981年3月に再発した。来院後患者は、再び褐色があせていくように感じた。過去3年の間、患者は光線性ほくろ予防のため、Fade-Outクリーム(Coparel Ltd)もしくはFortified Esotericaクリーム(Mitchum-Thayer Ltd)を1日2回、手の甲と前腕へ塗布していた。患者の見たところ、Fortified Esotericaクリームが日ごと黒ずんでいくようであった。検査の結果、指の爪全てに褐色の変色が認められた。クリームの使用を中止して1ヶ月後、爪の変色はほとんど完全に回復した。53) (Mann et al., 1983) HQによる副作用は通常穏やかである。灼熱感,刺痛感,発疹,そう痒などが報告されている。アレルギー性反応と思われるものもあったことから,HQによる治療を行う前にはパッチテストを行い,感受性を調査すべきである。HQは,目の周囲,開いた傷口,12歳以下の子供に使用すべきでない。54) (Gilman AG et al., 1980) 代謝 ヒト及びげっ歯目におけるHQの代謝は非常に似かよっているようであり、硫酸塩及びグルクロン酸抱合物が主要な代謝産物である。1,4-ベンゾキノン代謝産物を通して反応中間体が形成され得る。特にペルオキシダーゼによってマクロファージ内に反応中間体が形成されるのは、グルタチオンの抱合によって補足されるからかもしれない。反応中間体はDNA付加体を形成し、腎臓毒性の原因になるかもしれない。17) (IARC, 1999) ヒト肝ミクロソームにおけるHQのグルクロン酸抱合率は、個々の肝臓サンプル間で2-3倍の変動を示した。ヒトのグルクロン酸抱合率は、ラットの肝臓との比較でいくらか高く、マウスの肝臓との比較では低かった。55)(Seaton et al., 1995) 既存化学物質安全性(ハザード)評価シート8)(経済産業省, 2000) 発がん性 56)( ACGIH,1991), 57)( JETOC, 1999), 58)(日本産業衛生学会, 1999).  フィルム関連会社でのいくつかの疫学調査が報告されているが、いずれにおいても有意な腫瘍発生率の上昇は認められていない。5)(IPCS, 1994) 許容濃度 56)( ACGIH,1991), 58)(日本産業衛生学会, 1999).  生体内運命 本物質は速やかに消化管及び気管から吸収される。皮膚からの吸収は緩やかであるがアルコールなどの媒体の存在下では吸収速度が増加する。in vivo でのヒトの皮膚吸収速度は3 μg/cm2/h であり、このときの皮膚透過係数は2.25×10-6 cm/h であったとの報告がある。5) (IPCS, 1994) , 10) (Kari FW, 1989) 消化管及び気管から吸収された本物質は速やかに広範囲の組織に分布する。ラットに放射標識した本物質を投与した実験では、経口投与及び気管内投与では組織全体への分布が認められているが、特に腎臓及び肝臓への分布が顕著である。しかし静脈内投与した場合には、骨髄、胸腺及び脾臓の白脾髄への分布が認められており、投与経路の違いにより本物質の分布が変化することが示唆されている。5) (IPCS, 1994) 本物質は主に第二相代謝によりモノグルクロニド、モノサルフェート及びメルカプツール酸誘導体などの水溶性の抱合体へと変換され主に尿中へ排泄される。ラットに放射標識した本物質200 mg/kg を単回経口投与した実験では、48 時間以内に尿中に投与量の約90%の放射活性がみられ、糞、屍体及び呼気中にはそれぞれ4、1.2 及び0.4%が認められている。このときの尿中放射活性の50-60%がヒドロキノンモノグルクロニド由来、25-42%がヒドロキノンモノサルフェート由来である20, 22, 24)。しかしながらラット及びウサギに50mg/kg を腹腔内投与した実験では、尿中代謝物の約12%が1, 2, 4-トリヒドロキシベンゼンであったとの報告があり、投与経路により代謝のプロファイルが変化することが示されている。5) (IPCS, 1994) ラットに25 又は350 mg/kg を投与した実験で、尿中代謝物の投与量に対する比率に用量に相関した違いがみられており、高用量で排泄過程が飽和していることが示されている。また、血中濃度の経時的変化に二つのピークがみられ、このことは腸管循環が存在することを示している。5) (IPCS, 1994) 男性ボランティアに0.5 g/day までを経口投与した実験では、投与量の8-15%が未変化体として、40%が抱合体として尿中に排泄されている。56) ( ACGIH,1991) 本物質はベンゼンの代謝過程において産生される物質であること10) (Kari FW, 1989)及びペルオキシダーゼによって反応性の高い1, 4-ベンゾキノンへと代謝されうることが指摘されている。10) (Kari FW, 1989) ヒトへの影響 急性影響 大人が1 g を誤飲した事故例では、頭痛、耳鳴り、嘔吐、めまい、窒息感、呼吸異常、チアノーゼ、昏睡さらには尿の緑色化がみられている。59)(Devillers J, 1990) また、アメリカ海軍の船上で写真の現像液からヒドロキノンが冷水器に混入した事故では544 名の乗務員が暴露され、めまい、吐き気、下痢が報告されている。56)( ACGIH,1991) 自殺目的で摂取した例では、ヒドロキノン単独、又はヒドロキノンを含む写真の現像液を経口摂取して死亡している。これらの例での摂取量は3-12 g、80-200 mg/kg とされている。主な症状は振戦、嘔吐、腹痛、頭痛、頻脈、痙攣、反射消失、暗色尿、呼吸困難、チアノーゼ、昏睡である。5) (IPCS, 1994) 高濃度での暴露では眼への刺激、流涙、角膜の潰瘍がみられる。5) (IPCS, 1994), 56) ( ACGIH,1991), 59) (Devillers J, 1990) 眼への刺激は2.25mg/m3(0.5 ppm)の暴露で認められている。5) (IPCS, 1994) 皮膚では皮膚炎が発症し、5) (IPCS, 1994), 59) (Devillers J, 1990) 1%含有液の塗布で皮膚刺激とアレルギー症状が報告されている。5)(IPCS, 1994) 慢性影響 人の男性ボランティアに500 mg を5 ヵ月間、あるいは男性、女性のボランティア17人に300 mg を3-5 ヵ月間経口摂取させた実験では血液、尿に影響はみられていない。5) (IPCS, 1994), 59) (Devillers J, 1990) 840 人の人種の異なる男性ボランティアで行ったパッチテストでは、3%以下で影響はみられていないが、より小規模な別の実験では5%を含むクリームの適用部位での紅斑や痛みなどの一次刺激性が高頻度でみられている。5) (IPCS, 1994) 2%のハイドロキノンを含むクリームを2 ヵ月間使用した後に、5%のヒドロキノンモノベンジルエーテルを含むクリームを使用し、その2 日後に急性の皮膚炎が生じており、ヒドロキノンとヒドロキノンベンジルエーテルとの交差感作性が報告されている。パッチテストでは2 つとも陽性を示している。ヒドロキノン単独の感作性は弱いが、ヒドロキノンモノベンジルエーテル使用後の感作性は高頻度でみられている。5) (IPCS, 1994) 本物質を脱色剤として1.5-2%含むクリームがあり、本物質はメラニンの生成を抑制する。5) (IPCS, 1994) 本物質を5%含む強い脱色クリームを約3 年使用した黒人で組織褐色症が発生している。また、2%の濃度でも組織褐色症や、白斑が報告されている。5) (IPCS, 1994) 写真の現像液の使用では、0.06%の濃度で白斑がみられ、組織学的にメラノサイトとメラニン色素の減少が観察されている。5) (IPCS, 1994) 職業的暴露で角膜と結膜の変色が0.01-3.2 ppm(0.05-14.4 mg/m3)の2 年以上の暴露で認められている。5) (IPCS, 1994) 分類(OECD 分類基準・案) 60) (OECD,1996) 1) ほ乳動物に対する急性毒性は、経口投与ではマウス、ラット、ウサギでクラス4、経皮投与ではマウス、ラットでクラス5 に分類される。 2) 水圏環境生物に対する急性毒性は、藻類、甲殻類及び魚類のいずれに対してもvery toxicに分類される。 総合評価 危険有害性の要約 ヒトへの影響として、経口摂取では急性影響として頭痛、めまい、嘔吐、呼吸困難、チアノーゼ、昏睡等がみられ、3-12 g で死亡がみられる。また高濃度の暴露で眼への刺激性や傷害性、皮膚への適用で皮膚炎やアレルギー反応がみられ、皮膚への長期適用で組織褐色症や白斑が報告されている。実験動物でも眼、皮膚への刺激性と感作性が報告されているほか、中枢神経系、前胃、肝臓、腎臓、骨髄、脾臓への影響が報告されている。変異原性・遺伝毒性についてはin vitro、in vivo で陽性が多く報告されている。発がん性については実験動物ではラットで腎細胞腺腫、単核球性白血病、マウスで肝細胞腺腫/癌の有意な増加がみられているが、ヒトでは発がん性との関連が報告されておらず、IARC はグループ3に分類している。 本物質は環境中に放出された場合、大気中でのOH ラジカルとの反応による半減期は1日以内と計算される。水圏では主として生分解される。この他に嫌気的分解、直接光分解及び酸化により消失する。環境庁のモニタリングデータでは底質から検出されたことがある。水圏環境生物に対する急性毒性は藻類、甲殻類及び魚類で非常に強い。 指摘事項 (1) 眼、皮膚に刺激性を有し、感作性も報告されている。 (2) 中枢神経障害や血液への影響がみられる。 (3) 変異原性で陽性の報告が多く、マウスとラットで肝臓、腎臓及び血液の癌がみられている。 (4) 水圏環境生物に対する毒性が非常に強い。 ■参考文献 OECD database (link to SIDS) A1) ChemIDplus LiteFull Record: Hydroquinone RN: 123-31-9. 1) Korolev AA, Abinder AA, et al. [Hygienic and toxicologic features of products of phenol destruction in ozone treatment of water.] Gig Sanit. 1973; 38 (8): 6-10. No abstract available. In:CDC. Centers for Disease Control and Prevention. Documentation for Immediately Dangerous to Life or Health Concentrations (IDLHs).1996 Aug 16. 2) Deichmann WB, Keplinger ML. Phenols and phenolic compounds. 1963. ‘In: Patty FA, ed., Industrial Hygiene and Toxicology, Vol.II, Toxicology, New York, Interscience. p.1363-1383.’ No abstract available. In: IARC. International Agency for Research on Cancer. Monographs on the Evaluation of the Carcinogenic Risk of Chemicals to Man. Geneva: World Health Organization, International Agency for Research on Cancer. 1977. V15. p.168. 3) Takahashi A. Problems of hygiene maintenance for food coming into contact with rubber and plastics products. Nippon Gomu Kyokaishi. 1975; 48 (9): 537. No abstract available. In:CDC. Centers for Disease Control and Prevention. Documentation for Immediately Dangerous to Life or Health Concentrations (IDLHs).1996 Aug 16. 4) Woodward G, Hagan EC, Radomski JL. Toxicity of hydroquinone for laboratory animals. Fed Proc. 1949a; 8: 348. No abstract available. In:CDC. Centers for Disease Control and Prevention. Documentation for Immediately Dangerous to Life or Health Concentrations (IDLHs).1996 Aug 16. Available from:URL: 5) IPCS. International Programme on Chemical Safety. Environmental Health Criteria 157. Hydroquinone, 1994. Available from:URL: http://www.inchem.org/documents/ehc/ehc/ehc157.htm 要約: 国立医薬品食品衛生研究所安全情報部。HQ。 環境保健クライテリア 157 Environmental Health Criteria 157 Hydroquinone,(原著178頁,1994年発行) 更新日: 1997年1月7日,Last Updated :10 August 2000。 6) Zeidman I, Deutel R. Poisoning by hydroquinone and monomethyl - paraaminophenol sulfate: report of 2 cases with autopsy findings. Am J Med Sci. 1945; 210: 328-333. 7) CDC. Centers for Disease Control and Prevention. Documentation for Immediately Dangerous to Life or Health Concentrations (IDLHs).1996 Aug 16. Available from:URL: http://www.cdc.gov/niosh/123319.html 8) 経済産業省製造産業局化学物質管理課, 編 集 : 財団法人化学物質評価研究機構, 既存化学物質安全性(ハザード)評価シート, ヒドロキノン, 2000年(平成12 年4 月)作成, pp 1-15 9) Rodney JB, Differences in the nephrotoxicity of hydroqunone among Fisher 344 and Sprague-Dawley rats and B6C3F1 mice Journal of Toxicology and Environmental Health, 1996; 47(2), 159-172. 10) Kari FW. NTP. National Toxicology Program. NTP Toxicology and Carcinogenesis Studies of Hydroquinone (CAS No. 123-31-9) in F344/N Rats and B6C3F1 Mice (Gavage Studies). Natl Toxicol Program Tech Rep Ser. 1989; 366: 1-248. 11) Kari FW, Bucher J, Eustis SL, Haseman JK, Huff JE. Toxicity and carcinogenicity of hydroquinone in F344/N rats and B6C3F1 mice. Food Chem Toxicol. 1992 ; 30 (9): 737-747. PMID: 1365401 12) Altmann HJ, Grunow W, Wester PW, Mohr U. Induction of forestomach lesions by butylhydroxyanisole and structurally related substances. Arch Toxicol Suppl. 1985; 8: 114-116. PMID: 3868339 13) Peters MM, Jones TW, Monks TJ, Lau SS. Cytotoxicity and cell-proliferation induced by the nephrocarcinogen hydroquinone and its nephrotoxic metabolite 2,3,5-(tris-glutathion-S-yl)hydroquinone. Carcinogenesis. 1997; 18 (12): 2393-2401. PMID: 9450487 14) English JC, Hill T, O'Donoghue JL, Reddy MV. Measurement of nuclear DNA modification by 32P-postlabeling in the kidneys of male and female Fischer 344 rats after multiple gavage doses of hydroquinone. Fundam Appl Toxicol. 1994; 23 (3): 391-396. PMID: 7835540 15) English JC, Perry LG,Vlaovic M,Moyer C,O'Donoghue JL. Measurement of cell proliferation in the kidneys of Fischer 344 and Sprague-Dawley rats after gavage administration of hydroquinone. Fundam Appl Toxicol. 1994; 23 (3): 397-406. PMID: 7835541 16) Carlson AJ, Brewer NR. Toxicity studies on hydroquinone. Proc Soc Exp Biol Med. 1953; 84 (3): 684-688. PMID: 13134255 17) IARC. International Agency for Research on Cancer. Monographs on the Evaluation of the Carcinogenic Risk of Chemicals to Man. Geneva: World Health Organization, International Agency for Research on Cancer. 1999. Vol.71.p.691-719. 18) Dobo KL, Eastmond DA. Role of oxygen radicals in the chromosomal loss and breakage induced by the quinone-forming compounds, hydroquinone and tert-butylhydroquinone. Environ Mol Mutagen. 1994; 24 (4): 293-300. PMID: 7851341 19) Jagetia GC, Aruna R. Hydroquinone increases the frequency of micronuclei in a dose-dependent manner in mouse bone marrow. Toxicol Lett. 1997; 93 (2-3): 205-213. PMID: 9486957 20) Silva Mdo C, Gaspar J, Duarte Silva I, Faber A, Rueff J. GSTM1, GSTT1, and GSTP1 genotypes and the genotoxicity of hydroquinone in human lymphocytes. Environ Mol Mutagen. 2004; 43 (4): 258-264. PMID: 15141365 21) Roza L, de Vogel N, van Delft JH. Lack of clastogenic effects in cultured human lymphocytes treated with hydroquinone. Food Chem Toxicol. 2003; 41 (10): 1299-1305. PMID: 12909262 22) Andreoli C, Rossi S, Leopardi P, Crebelli R. DNA damage by hydroquinone in human white blood cells: analysis by alkaline single-cell gel electrophoresis. Mutat Res. 1999; 438 (1): 37-45. PMID: 9858677 23) Shibata MA, Hirose M, Tanaka H, Asakawa E, Shirai T, Ito N. Induction of renal cell tumors in rats and mice, and enhancement of hepatocellular tumor development in mice after long-term hydroquinone treatment. Jpn J Cancer Res. 1991; 82 (11): 1211-1219. PMID: 1752780 24) Krasavage WJ, Blacker AM, English JC, Murphy SJ. Hydroquinone: a developmental toxicity study in rats. Fundam Appl Toxicol. 1992; 18 (3): 370-375. PMID: 1597262 25) Murphy SJ, Schroeder RE, Blacker AM, Krasavage WJ, English JC. A study of developmental toxicity of hydroquinone in the rabbit. Fundam Appl Toxicol. 1992; 19 (2): 214-221. PMID: 1516778 26) Blacker AM, Schroeder RE, English JC, Murphy SJ, Krasavage WJ, Simon GS. A two-generation reproduction study with hydroquinone in rats. Fundam Appl Toxicol. 1993; 21 (4): 420-424. PMID: 8253295 27) Burgaz S, Ozcan M, Ozkul A, Karakaya AE. Effect of hydroquinone (HQ) on the development of chick embryos. Drug Chem Toxicol. 1994; 17 (2): 163-174. PMID: 8062643 28) Bleehen SS, Pathak MA, Hori Y, Fitzpatrick TB. Depigmentation of skin with 4-isopropylcatechol, mercaptoamines, and other compounds. J Invest Dermatol. 1968; 50(2): 103-117. PMID: 5641641. In: IPCS. International Programme on Chemical Safety. Environmental Health Criteria 157. Hydroquinone, 1994. 29) Rajka G, Blohm SG. The allergenicity of paraphenylendiamine. II. Acta Derm Venereol. 1970; 50(1): 51-54. PMID: 4191888. In: IPCS. International Programme on Chemical Safety. Environmental Health Criteria 157. Hydroquinone, 1994. 30) Jimbow K, Obata H, Pathak MA, Fitzpatrick TB. Mechanism of depigmentation by hydroquinone. J Invest Dermatol. 1974 ; 62(4): 436-449. In: IPCS. International Programme on Chemical Safety. Environmental Health Criteria 157. Hydroquinone, 1994. 31) Springborn Institute for Bioresearch (1984) Photoallergic contact dermatitis in guinea-pigs (Armstrong method) : Final report (Unpublished data from Springborn Institute for Bioresearch, submitted to WHO by CFTA). In: IPCS. International Programme on Chemical Safety. Environmental Health Criteria 157. Hydroquinone, 1994. 32) Maibach HJ, Patrick E, (1989) A study to evaluate the potential of mono-T-butyl hydroquinone to produce skin depigmentation. Kingsport, Tennessee, Eastman Kodak Company (Report No. HIM 88-KOD-DEPIG-01). In: IPCS. International Programme on Chemical Safety. Environmental Health Criteria 157. Hydroquinone, 1994. 33) van der Walle HB, Klecak G, Geleick H, Bensink T. Sensitizing potential of 14 mono (meth) acrylates in the guinea pig. Contact Dermatitis 1982a; 8: 223-235. PMID: 7105684. In: IPCS. International Programme on Chemical Safety. Environmental Health Criteria 157. Hydroquinone, 1994. 34) van der Walle HB, Delbressine LP, Seutter E. Concomitant sensitization to hydroquinone and P-methyoxyphenol in the guinea pig; inhibitors in acrylic monomers. Contact Dermatitis. 1982b; 8(3): 147-154. PMID: 7094569. In: IPCS. International Programme on Chemical Safety. Environmental Health Criteria 157. Hydroquinone, 1994. 35) Basketter DA, Goodwin BF, Investigation of the prohapten concept. Cross reactions between 1,4-substituted benzene derivatives in the guinea pig. Contact Dermatitis, 1988; 19(4): 248-253. In: IPCS. International Programme on Chemical Safety. Environmental Health Criteria 157. Hydroquinone, 1994. 36) Deisinger PJ, English JC. Bioavailability and metabolism of hydroquinone after intratracheal instillation in male rats. Drug Metab Dispos. 1999; 27(4): 442-448. PMID: 10101138. 37) Divincenzo GD, Hamilton ML, Reynolds RC, Ziegler DA. Metabolic fate and disposition of [14C]hydroquinone given orally to Sprague-Dawley rats. Toxicology 1984; 33 (1): 9-18. PMID: 6495348 38) Kodak Health & Environmental Laboratories.( EPA/OTS; Doc #878214473). The Metabolic Fate of [U-14C] Hydroquinone Administered By Gavage To Male Fischer 344 Rats. 1984. EPA Document No. 878214473, Fiche No. OTS0206577 In: TOXONET. 878214473 in HSDB (Hazardous Substances Data Bank). Animal Toxicity Studies. 2003. TOXONET. 39) Li Y, Lafuente A, Trush MA. Characterization of quinone reductase, glutathione and glutathione S-transferase in human myeloid cell lines: induction by 1,2-dithiole-3-thione and effects on hydroquinone-induced cytotoxicity. Life Sci. 1994; 54 (13): 901-916. PMID: 7511200 40) Deichmann WB, Keplinger ML., in Patty’s Indystrial Hygiene and Toxicology vol. 2A, Clayton GD, Clayton FE (eds.) Wiley-Interscience, New York, 3rd., 1981. pp 2589-2592. In: Budavari S. (ed.). The Merck Index Encyclopedia of Chemicals, Drugs and Biologicals. (11th ed.). 4738. Hydroqunone. Merck and Co., Inc., Whitehouse Satation, NJ. 1989. p.762-763. 41) Kersey P, Stevenson CJ. Vitiligo and occupational exposure to hydroquinone from servicing self-photographing machines. Contact Dermatitis. 1981; 7 (5): 285-287. PMID: 7307500 42) NIOSH Pocket Guide to Chemical Hazards. HYDROQUINONE. updated 03-21-03 2003 Available from:URL: http://www.cdc.gov/niosh/npg/npgd0338.html, ICSC: 0166 43) The Physical and Theoretical Chemistry Laboratory, Oxford University Chemical and Other Safety Information, This information was last updated on November 11, 2004. Safety (MSDS) data for hydroquinone. 44) Choudat D, Neukirch F, Brochard P, Barrat G, Marsac J, Conso F. Allergy and occupational exposure to hydroquinone and to methionine. Br J Ind Med. 1988; 45 (6): 376-80. PMID: 3395573. In: 国立医薬品食品衛生研究所安全情報部。HQ。 環境保健クライテリア 157 Environmental Health Criteria 157 Hydroquinone,(原著178頁,1994年発行) 更新日: 1997年1月7日,Last Updated :10 August 2000。 45) Anderson B. Corneal and conjunctival pigmentation among workers engaged in manufacture of hydroqunone. Arch Ophthalmol. 1947: 38; 812-826. In: Amdur MO, Doull J, Klaasen CD.(eds). Casarett and Doull's Toxicology. 4th ed. New York、 NY: Pergamon Press, 1991. p 527. 46) Torres V, Mano-Azul AC, Correia T, Soares AP. Allergic contact cheilitis and stomatitis from hydroquinone in an acrylic dental prosthesis. Contact Dermatitis. 1993; 29 (2): 102-103. No abstract available. PMID: 8365170 47) Barrientos N, Ortiz-Frutos J, Gomez E, Iglesias L. Allergic contact dermatitis from a bleaching cream. Am J Contact Dermat. 2001; 12 (1): 33-4. PMID: 11244138 48) PDR. Physician's Desk Reference. 58th edition. Montvale: Thomson Healthcare; 2004. Hydroquinone; p.3179-3180. 49) Haddad AL, Matos LF, Brunstein F, Ferreira LM, Silva A, Costa D Jr. A clinical, prospective, randomized, double-blind trial comparing skin whitening complex with hydroquinone vs. placebo in the treatment of melasma. Int J Dermatol. 2003; 42 (2): 153-156. PMID: 12709008 50) Fisher AA. The safety of bleaching creams containing hydroquinone. Cutis. 1998; 61 (6): 303-304. No abstract available. PMID: 9770123 51) Camarasa JG, Serra-Baldrich E. Exogenous ochronosis with allergic contact dermatitis from hydroquinone. Contact Dermatitis. 1994; 31 (1): 57-58. PMID: 7924303 52) Barber ED, Hill T, Schum DB. The percutaneous absorption of hydroquinone (HQ) through rat and human skin in vitro. Toxicol Lett. 1995; 80 (1-3): 167-172. PMID: 7482585 53) Mann RJ, Harman RR. Nail staining due to hydroquinone skin-lightening creams. Br J Dermatol. 1983; 108 (3): 363-365.PMID: 6219692 54) Gilman AG, Goodman LS, Gilman A. (eds.). Goodman and Gilman's The Pharmacological Basis of Therapeutics. 6th ed. New York: Macmillan Publishing Co., Inc. 1980. p.959. 55) Seaton MJ, Schlosser P, Medinsky MA. In vitro conjugation of benzene metabolites by human liver: potential influence of interindividual variability on benzene toxicity. Carcinogenesis. 1995; 16 (7): 1519-1527. PMID: 7614685 56) ACGIH, Documentation of the Threshold Limit Values and Biological Exposure Indices (1991). In: 経済産業省製造産業局化学物質管理課, 編 集 : 財団法人化学物質評価研究機構, 既存化学物質安全性(ハザード)評価シート, ヒドロキノン, 2000年(平成12 年4 月)作成, pp 1-15. 57) JETOC, 発がん性物質の分類とその基準, 発がん性評価物質一覧表, 第4 版(1999). In: 経済産業省製造産業局化学物質管理課, 編 集 : 財団法人化学物質評価研究機構, 既存化学物質安全性(ハザード)評価シート, ヒドロキノン, 2000年(平成12 年4 月)作成, pp 1-15. 58) 許容濃度等の勧告, 産業衛生学雑誌, 41, 96-158(1999)日本産業衛生学会 In: 経済産業省製造産業局化学物質管理課, 編 集 : 財団法人化学物質評価研究機構, 既存化学物質安全性(ハザード)評価シート, ヒドロキノン, 2000年(平成12 年4 月)作成, pp 1-15. 59) Devillers J, Ecotoxicology and Environmental Safety, 19, 327-354 (1990). In: 経済産業省製造産業局化学物質管理課, 編 集 : 財団法人化学物質評価研究機構, 既存化学物質安全性(ハザード)評価シート, ヒドロキノン, 2000年(平成12 年4 月)作成, pp 1-15. 60) OECD, Proposal for a Harmonized Classification System based on Acute Toxicity (1996). In: 経済産業省製造産業局化学物質管理課, 編 集 : 財団法人化学物質評価研究機構, 既存化学物質安全性(ハザード)評価シート, ヒドロキノン, 2000年(平成12 年4 月)作成, pp 1-15. |メニューへ| |
| Japan Pharmaceutical Excipients Council |